(浙江中医药大学生命科学学院,浙江杭州 310053)
糖苷酶(Glycoside hydrolases, GH, EC 3.2.1),又称糖苷水解酶,广泛存在于生物体中,在自然界糖苷键的水解过程中扮演着非常重要的角色。糖苷酶作为一类重要的化合物,在食品、医疗、工业等领域都有着十分广泛的利用价值。但目前已知存在的糖苷酶大多数都存在酶活力低的问题,且该酶来源十分匮乏。因此,寻找天然产耐有机溶剂糖苷酶的微生物显得尤为重要。本实验采用含有机溶剂的培养基,筛选能产耐有机溶剂糖苷酶的微生物,并对所得微生物进行生物学鉴定,优化产酶条件,为进一步的研究和应用提供酶源和基础数据。
1 材料与方法
1.1 材料
1.1.1 主要设备与材料台式高速冷冻离心机,德国希格玛离心机有限公司,singma3K15型;PCR自动系列化分析仪,德国耶拿分析仪,Tpersonal型;琼脂糖水平电泳仪,北京市六一仪器厂,DYCP-32A型。
浙江台州路桥某家化工企业所排污水长期污染过的土样。羧甲基纤维素钠(CM C-N a)、N,N-二甲基甲酰胺(DMF)、对硝基苯酚-p-D-葡萄糖苷、HEPES。
1.1.2 培养基
富集培养基:羧甲基纤维素钠(CMC-Na)10.0 g/L,DMF 5%,胰蛋白胨25.0 g/L,酵母提取物3.0 g/L,NaCl 5.0 g/L,KHPO3.0 g/L,KHPO1.0 g/L,微量元素液100 mL/L(MgSO·7HO 0.3g,FeSO·7HO 0.005 g,CaCl0.005g,溶于100 ml蒸馏水中),pH 7.0。
初筛培养基:将富集培养基中的胰蛋白胨替换成(NH)SO5.0 g/L。
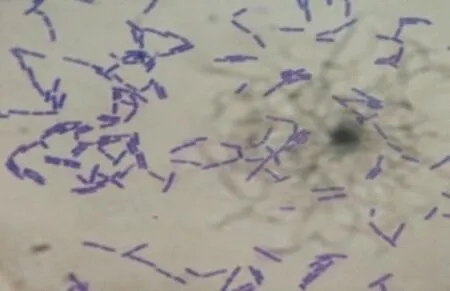
图1 产耐有机溶剂糖苷酶微生物显微形态
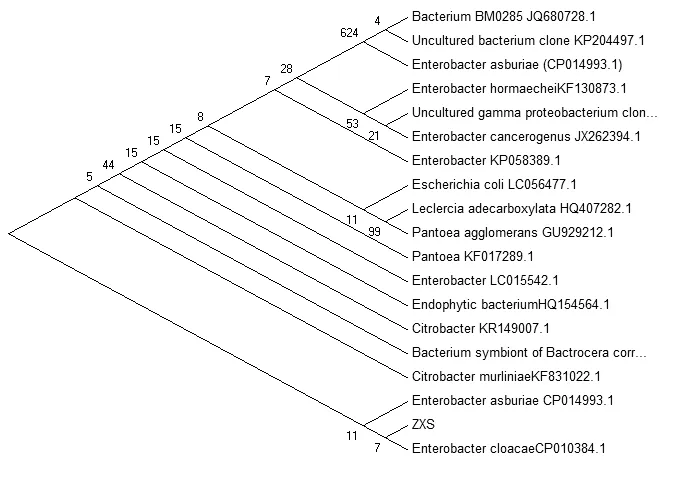
图2 菌株ZXS的16SrDNA序列比对
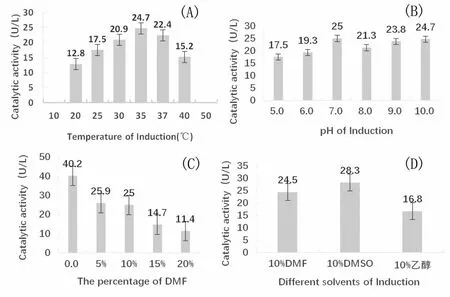
图3 不同因素对酶活力的影响
复筛液体培养基:羧甲基纤维素钠(CM C-Na)10.0 g/L,蛋白胨 3.0 g/L,酵母提取物2.0 g/L,DMF 5%,(NH)SO5.0 g/L,NaCl 5 g/L,KHPO3 g/L,KHPO1.0 g/L,微量元素溶液100 mL/L,pH 7.0。1.2 方法
1.2.1 富集培养
将采集的土壤悬浮在装有90 mL已灭菌的生理盐水的锥形瓶中,在180 r/min,30 ℃条件下的摇床中震荡30 min,取部分菌液转移到富集液体培养基进行培养,然后重复转接2次。
1.2.2 初筛
选择有明显的微生物生长的富集培养液,取部分富集培养液涂布于初筛固体培养基上,30 ℃恒温箱中培养24 h,观察平板上微生物生长情况。
1.2.3 复筛及酶活测定
从初筛培养基中挑取明显生长的单菌落于复筛液体培养基中培养,然后取菌悬液离心收集菌体,再用等体积的50 mM HPPES(pH7.0)缓冲液重悬,制得菌悬液,以对硝基苯酚葡萄糖苷为底物,测其糖苷酶活力大小。
1.2.4 菌种鉴定
分离纯化菌种,观察纯种菌种的菌落形态,包括菌落大小,颜色,湿度,边缘等;用革兰氏染色,用显微镜观察细菌形态;根据试剂盒提取基因组DN A,然后进行PCR扩增(50 μl的体系:去离子水21 μl,PrimeSTAR MAX Premix 25 μl,基因组1 μl,引物pF-rRNA和pR-rRNA各1.5 μ l),琼脂糖凝胶电泳检测PCR结果。接着对PCR产物割胶回收,利用割胶回收试剂盒纯化基因组以及回收基因组。最后,进行测序,在基因库进行比对,制作进化树。
2 实验结果与分析
2.1 微生物鉴定
2.1.1 形态鉴定对微生物进行革兰氏染色,并在显微镜下观察其染色情况以及形态,实验结果如图1所示,微生物革兰氏染色呈紫色,所以该微生物属于革兰氏阳性菌,并且微生物的形态呈杆状,杆状比较短,属于短杆菌类。
2.1.2 分子生物学鉴定
通过提取基因组,再进行PCR,琼脂糖凝胶电泳后进行割胶回收纯化基因,并将片段收回用于测序。经过序列比对,得出该微生物的生长进化树如图2所示。经过序列比对得出该微生物与Enterobacter cloacae(阴沟肠杆菌)一类序列最为接近。
2.2 微生物产酶性质研究
2.2.1 反应温度对酶活力的影响对于反应温度进行优化,分别考察了20、25、30、35、37、40 ℃条件下微生物ZXS的产酶活力,每个条件都进行3次平行重复试验。结果如图3(A)所示,随着反应温度的不断升高,该酶活力先升高达到最大值后再降低,其中在温度为35 ℃时产酶效果最佳。
2.2.2 反应体系pH值对酶活力的影响
对于反应体系中的p H进行优化,分别在p H为5.0、6.0、7.0、8.0、9.0、10.0的条件下进行考察,每个条件进行3次平行重复试验,再检测微生物ZXS的产酶活力。结果如图3(B)所示,随着pH的变化酶活力也在不断地变化,总体趋势是随着pH的不断增大,酶活力呈现上升趋势,其中pH为7.0和10.0时酶活力达到最高,接近相等,所以该菌株在一定程度上具有耐受碱性能力,并且在pH 5.0~10.0之间时,此酶的催化活力都相对较稳定。
2.2.3 DMF浓度对酶活力的影响
对于反应体系中有机溶剂试剂DMF的含量进行考察,分别选取了不含DMF试剂,含5%、10%、15%、20%DMF的反应体系进行反应,每个条件进行3次平行重复试验,再检测微生物ZXS的产酶活力。结果如图3(C)所示,随着DMF浓度的升高,菌株的产酶性能逐渐减弱,但并没有完全抑制酶活力,所以总体上D MF对该酶的酶活力有一定的抑制作用。
2.2.4 不同有机溶剂对酶活力的影响
对于微生物ZXS的耐有机溶剂性能进行考察,在反应体系中分别含有10%的DMF、二甲基亚砜(DMSO)、无水乙醇的条件下进行催化反应,每个条件进行3次重复试验,再检测微生物ZXS的产酶活力。结果如图3(D)所示,该菌株在相同条件下对二甲基亚砜的耐受力更好,对无水乙醇的耐受力最差。
3 结语
本实验筛选得到1株产耐有机溶剂糖苷酶的微生物,命名为ZXS,属于Enterobacter cloacae(阴沟肠杆菌)类革兰氏阳性菌株。该菌株在无有机溶剂的情况下酶活最高达到40.2U/L。经进一步对其产酶条件的优化,菌株培养8h后,在反应温度为35℃,pH为7.0,DMF含量为5%时,酶活力最高达到25.9U/L。[1]黄红卫,刘艳丽,李春.糖苷酶的研究及其改造策略[J].生物技术通报,2010,(5):55-60.
[2]Jacobson R, Schlein Y, Eisenberger C. The biological function of sandfly and leishmania glycosidases[J]. Medical Microbiology and lmmunology, 2001, 190: 51-55.
[3]邵金辉,韩金祥,朱有名,等.β-葡萄糖苷酶在工农医领域的应用[J].生命的化学,2005,5(1):22-24.
[4]Gautams S, Simon L. Partitioning of β-glucosidase from Trichoderma reesei in poly and potassium phosphate aqueous two-phase systems: Influence of pH and temperature[J]. Biochemical Engineering Journal, 2006, 30: 104-108.
[5]王华夫,游小青.茶叶中β-葡萄糖苷酶活性的测定[J].中国茶叶,1996(3):16-17.
[6]Miller G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry,1959,31(3):426-428.
[7]周兰兰,李江华,刘龙,等.耐有机溶剂α-葡萄糖苷酶的筛选及转化槲皮苷条件的优化[J].工业微生物,2013, 43(5):8-12.